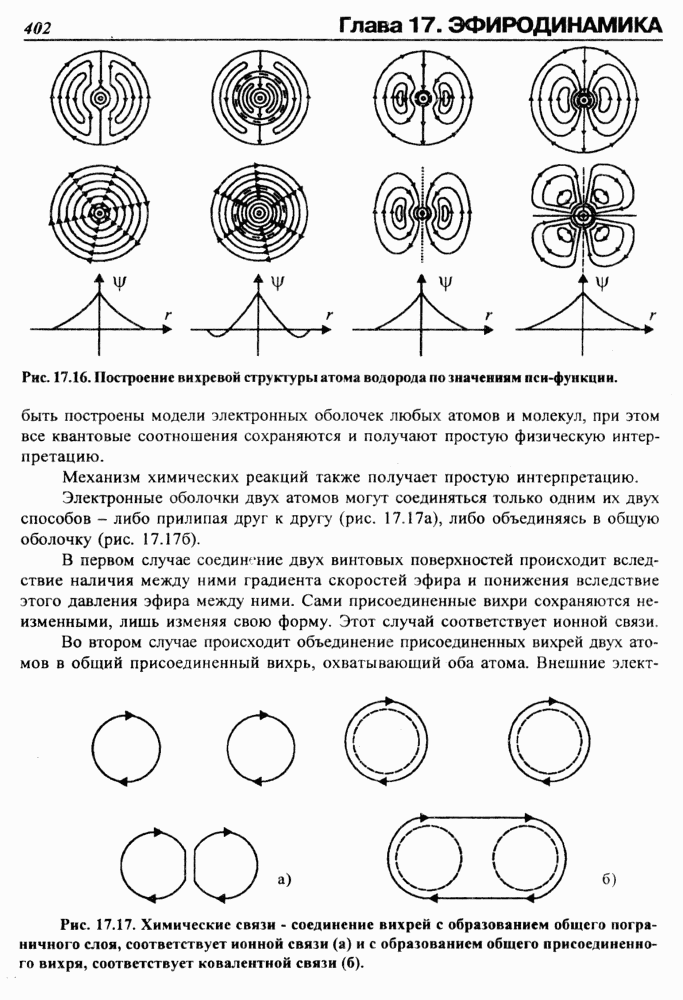

Рис. 17.16. Построение вихревой структуры атома водорода по значениям пси-функции.
быть построены модели электронных оболочек любых атомов и молекул, при этом все квантовые соотношения сохраняются и получают простую физическую интерпретацию.
Механизм химических реакций также получает простую интерпретацию.
Электронные оболочки двух атомов могут соединяться только одним их двух способов - либо прилипая друг к другу (рис. 17.17а), либо объединяясь в общую оболочку (рис. 17.176).
В первом случае соединение двух винтовых поверхностей происходит вследствие наличия между ними градиента скоростей эфира и понижения вследствие этого давления эфира между ними. Сами присоединенные вихри сохраняются неизменными, лишь изменяя свой форму. Этот случай соответствует ионной связи.
Во втором случае происходит объединение присоединенных вихрей двух атомов в общий присоединенный вихрь, охватывающий оба атома. Внешние элект-
Рис. 17.17. Химические связи - соединение вихрей с образованием общего пограничного слоя, соответствует ионной связи (а) и с образованием общего присоединенного вихря, соответствует ковалентной связи (б).
ронные оболочки двух атомов объединяются в одну общую. Длина потоков эфира в общем присоединенном вихре меньше, чем сумма длин потоков в присоединенных вихрях двух отдельных атомов, поэтому часть завинтованного уплотненного эфира выбрасывается из молекулы. Рассмотренный случай соответствует ковалентной связи.
104,5°
Рис. 17.19. Структура Рис. 17.18. Структура молекулы водорода Н2. молекулы воды.
Соединение присоединенных вихрей атомов первым или вторым способами приводит к созданию молекул (рис. 17.17, 17.18).
В случае ковалентной связи длина линии тока эфира в общем присоединенном вихре оказывается меньше, чем сумма длин присоединенных вихрей атомов до их объединения. Излишний уплотненный и завинтованный эфир выбрасывается из молекулы. Если по соседству происходит реакция разъединения, то этот эфир будет поглощен. Подобные реакции идут во всех живых тканях, что проявляется в .виде «свечения Кирлиан».
17.5.4. Межмолекулярные взаимодействия, ван-дер-ваальсова оболочка и аура первого рода
Природа сил, удерживающих в составе тел атомы и молекулы, длительное время была неясной. Но в 1873 г. голландский физик Ван-дер-Ваальс впервые учел наличие межмолекулярных взаимодействий при объяснении свойств реальных газов и жидкостей. Он предположил, что на малых расстояниях между молекулами действуют силы отталкивания, которые с увеличением расстояния сменяются силами притяжения. Природу этих сил Ван-дер-Ваальс не рассматривал, так же как и количественные зависимости. Однако само представление о существовании этих сил позволило ему вывести уравнение состояния для реального газа.
В дальнейшем межмолекулярные силы рассматривались применительно ко всем видам веществ.
В настоящее время считается, что межмолекулярные взаимодействия имеют электрическую природу и складываются из сил притяжения - ориентационных, индукционных и дисперсионных, а также сил отталкивания.
Ориентационные силы действуют между полярными молекулами, обладающими дипольными моментами.